INFORME TÉCNICO DO CRF-MS – Orientações aos farmacêuticos sobre as regras de intercambialidade de medicamentos
A Assessoria Técnica do Conselho Regional de Farmácia de Mato Grosso do Sul (CRF-MS), diante da multiplicidade de solicitações de orientações e esclarecimentos técnicos esclarece a todos os farmacêuticos sobre as normas vigentes e regras atuais a respeito da intercambialidade de medicamentos no Brasil, conforme regras definidas pela Agência Nacional de Vigilância Sanitária.
As dispensações realizadas pelas farmácias e drogarias de todo o país, inclusive no âmbito do Programa Farmácia Popular do Brasil (PFPB), devem seguir as legislações da Anvisa que tratam da intercambialidade, conforme previsto no art. 37, alínea XVIII do Anexo LXXVII da Portaria de Consolidação nº 05/2017:
Art. 37. O descumprimento de qualquer das regras dispostas neste Anexo, pelas farmácias e drogarias, caracteriza prática de irregularidade no âmbito do PFPB, considerando-se irregulares as seguintes situações, entre outras:
XVIII - realizar a substituição do medicamento prescrito em desacordo com a legislação vigente;
Conceitos definidos pela Anvisa:
- Medicamento genérico: é aquele que contém o (s) mesmo (s) princípio (s) ativo (s), na mesma dose e forma farmacêutica, é administrado pela mesma via e com a mesma posologia e indicação terapêutica do medicamento de referência, apresentando eficácia e segurança equivalentes à do medicamento de referência e podendo, com este, ser intercambiável.
- Medicamento similar: é aquele que contém o mesmo princípio ativo do seu medicamento de referência e é identificado pela marca ou nome comercial. Ele só pode substituir seu respectivo medicamento de referência após passar por testes laboratoriais que comprovem a equivalência. Os que já cumpriram esse processo são chamados de “similares intercambiáveis”.
- Medicamento similar intercambiável: é aquele medicamento similar ao de referência que, além de possuír as mesmas características do medicamento similar — como princípio ativo, concentração, forma farmacêutica, via de administração, posologia e indicação terapêutica —, passou por testes rigorosos que comprovam sua bioequivalência terapêutica em relação ao medicamento de referência. É considerado intercambiável, o medicamento similar cujos estudos de equivalência farmacêutica, biodisponibilidade relativa/bioequivalência ou bioisenção tenham sido apresentados, analisados e aprovados pela ANVISA.
O profissional farmacêutico, em decisão conjunta com o paciente, em comum acordo e sem imposições, poderá realizar a substituição ou a intercambialidade do medicamento prescrito para outro medicamento disponível na farmácia da seguinte forma:
- Se o medicamento estiver prescrito seguindo a Denominação Comum Brasileira (DCB):
Pode ser dispensado tanto o medicamento genérico, quanto o medicamento de referência.
- Se o medicamento estiver prescrito com o nome do MEDICAMENTO REFERÊNCIA:
Pode ser dispensado tanto o medicamento de referência, quanto o medicamento genérico ou um similar intercambiável (equivalente).
- Se o medicamento estiver prescrito com o nome do MEDICAMENTO SIMILAR:
Pode ser dispensado o medicamento referência se este for intercambiável (equivalente) ou somente o medicamento similar prescrito se este não for intercambiável (não equivalente).
Diante do exposto, os critérios para a dispensação de medicamentos genéricos, referência e similares devem seguir as legislações da Anvisa, respeitada a decisão expressa da não intercambialidade manifestada pelo profissional prescritor na receita, conforme figura abaixo.
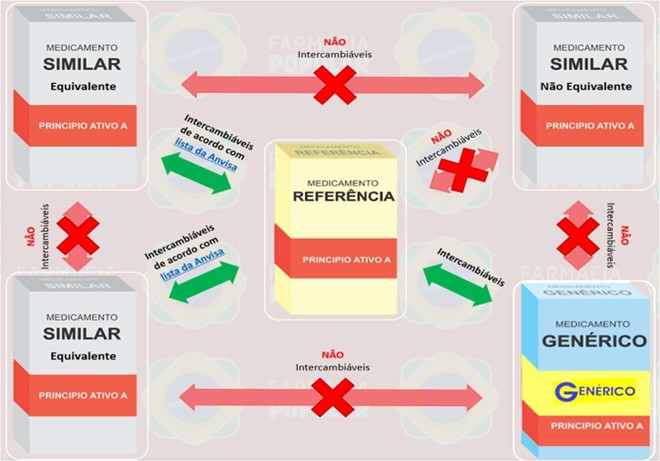
Fonte imagem, adaptada: Pharma HPC, Brasília.
RDC 16/2007 — Regulamento Técnico para Medicamentos Genéricos
Dispensação:
Será permitida ao profissional farmacêutico a substituição do medicamento prescrito pelo medicamento genérico correspondente, salvo restrições expressas pelo profissional prescritor.
Nos casos de prescrição com a Denominação Comum Brasileira (DCB) ou a Denominação Comum Internacional (DCI), somente será permitida a dispensação do medicamento de referência ou de genérico correspondentes.
Após a alteração pela RDC 51/2007: “O medicamento genérico somente será dispensado se prescrito pela DCB ou, na sua falta, pela DCI, podendo ser intercambiável com o respectivo medicamento referência.
E ainda: O medicamento de referência poderá ser dispensado quando prescrito pelo seu nome de marca ou pela respectiva DCB ou, na sua falta, pela DCI, podendo ser intercambiável com o medicamento genérico correspondente.” (subitem 2.3.1, adicionado pela RDC 51/2007).
Como saber quais medicamentos são intercambiáveis?
Desde 2014, a Agência publica e atualiza a lista de medicamentos similares intercambiáveis. Entretanto, a publicação e a atualização de uma lista não são produtivas, pois ela se torna ultrapassada muito rapidamente sempre que um registro de medicamento similar é publicado – o que pode ocorrer quase toda semana!
Além disso, os levantamentos necessários para criar e revisar a lista requerem que uma força de trabalho cada vez mais escassa da Anvisa precise ser retirada de outras atividades, incluindo respostas ao cidadão e análise de outros pedidos de registro.
Assim, em cumprimento ao art. 2º, parágrafo único, da RDC 58/2014, a Agência divulga novas instruções para se obter a relação de medicamentos similares intercambiáveis – através do sistema de Consultas. Ressalta-se que as informações obtidas dessa forma são atualizadas diariamente, o que garante dados mais atuais do que a publicação de listas.
Os pacientes e profissionais da saúde podem seguir as orientações abaixo para obter informações atualizadas sobre medicamentos similares intercambiáveis.
Como saber quais medicamentos similares são intercambiáveis com um medicamento de referência?
1. Entre na seção de consulta de medicamentos, pelo link https://consultas.anvisa.gov.br/#/medicamentos/
2. No campo “Categoria Regulatória”, selecione a opção “Similar”.
3. No campo “Medicamento de referência”, digite o nome comercial do medicamento de referência.
4. Clique em “Consultar”.
Você será redirecionado para uma relação de todos os medicamentos similares que sejam intercambiáveis com o medicamento de referência pesquisado.
A consulta pode ser feita com outros filtros, caso necessário. Por exemplo, pelo CNPJ do detentor do registro, nome do produto.
Além disso, o medicamento similar intercambiável é obrigado pela RDC 58/2014 a inserir esta informação em sua bula. Portanto, uma forma de confirmar que o medicamento similar é intercambiável é consultar a sua bula, disponível em https://consultas.anvisa.gov.br/#/bulario/
Como saber se um medicamento similar é intercambiável, e com qual medicamento de referência?
1. Entre na seção de consulta de medicamentos, pelo link https://consultas.anvisa.gov.br/#/medicamentos/
2. Preencha os campos “Nome do produto” e/ou “Número do registro”.
3. Você será redirecionado para uma tabela com o(s) produto(s) que cumpre(m) com o critério de busca.
4. Clique na linha que corresponde ao produto desejado.
5. Você será redirecionado para as informações detalhadas do produto – verifique o medicamento de referência com o qual o produto é intercambiável no campo “Medicamento de Referência”.
Observação: o medicamento de referência que consta neste campo é aquele com o qual este produto é intercambiável, e não necessariamente o medicamento de referência indicado pela Anvisa no momento, já que em determinadas situações (por exemplo, cancelamento de registro de um medicamento de referência) pode ser necessário indicar outro medicamento de referência.
Além disso, o medicamento similar intercambiável é obrigado pela RDC 58/2014 a inserir esta informação em sua bula. Portanto, uma forma de confirmar que o medicamento similar é intercambiável é consultar a sua bula, disponível em https://consultas.anvisa.gov.br/#/bulario/
Para saber mais sobre os ensaios de bioequivalência em medicamentos similares, clique aqui!
ENSAIOS DE BIOEQUIVALÊNCIA DOS SIMILARES
Testes de bioequivalência para medicamentos similares, exigidos pela ANVISA no Brasil, comprovam que eles possuem a mesma eficácia e segurança que o medicamento de referência, garantindo que o princípio ativo atue da mesma forma no organismo, atingindo concentrações sanguíneas e tempos de absorção similares aos do medicamento original (de referência), com o objetivo de assegurar a intercambialidade para médicos e pacientes. Esses testes são cruciais para a aprovação e comercialização, transformando similares em "intercambiáveis", muitas vezes identificados por um símbolo "EQ" e permitindo a troca segura por genéricos ou referência.
A obrigatoriedade de comprovação de equivalência farmacêutica ou bioequivalência terapêutica para medicamentos similares começou com no Brasil em 2002 com a RDC 157, de 31 de maio de 2002 — com regras para registro de medicamentos similares.
Já em 2003 foi publicada a RDC 133/2003 (e também a RDC 134/2003) que detalhou que os medicamentos similares deveriam apresentar ao setor de registros da Anvisa estudos de equivalência farmacêutica e, quando aplicável, de biodisponibilidade relativa (ensaios de bioequivalência) para o processo de renovação de registro.
Em 2007, a RDC 17/2007 consolidou a exigência de registro de medicamentos similares sob critérios semelhantes aos dos genéricos, determinando que apenas centros habilitados pela Anvisa podem realizar os testes de equivalência farmacêutica e os de biodisponibilidade relativa.
Em 2015, a Lei 13.235/2015 reforçou a exigência de que os similares comprovassem a equivalência aos genéricos, tornando obrigatório que medicamentos similares — nacionais ou importados — passem pelos mesmos ensaios de bioequivalência e controles de qualidade exigidos para os medicamentos genéricos.
O que a exigência significa na prática?
Para que um similar seja autorizado no país, é necessário apresentar testes de equivalência farmacêutica comparando aspectos e desempenho em testes laboratoriais in vitro, como teste ou perfil de dissolução, tempo de absorção, concentração sanguinea, dentre outros).
Quando o medicamento exige absorção para exercer efeito (por exemplo, comprimidos orais), também é exigido estudo de biodisponibilidade relativa / bioequivalência (in vivo).
Se os testes forem aprovados, o similar pode ser registrado como tal e, dependendo da regulamentação, em alguns casos pode até se tornar “intercambiável” com o medicamento de referência.
Com a publicação da RDC 58/2014, essa intercambialidade passou a valer a partir de 1º de janeiro de 2015 para os similares que tivessem passado pelos ensaios de bioequivalência.
Identificação no Mercado
Medicamentos similares que passam por esses testes e são aprovados tornam-se "intercambiáveis".
Podem exibir um símbolo "EQ" (Equivalente) na embalagem, similar ao dos genéricos, facilitando a identificação pelo consumidor e profissional de saúde.
Como Consultar:
Você pode verificar no site da ANVISA se um medicamento similar é intercambiável, buscando pelo nome e verificando se o medicamento de referência é indicado.



